Nat Biomed Eng:通过工程化改造T细胞或能帮助癌症患者克服对CAR-T细胞疗法的耐受性
来源:生物谷原创 2025-01-03 14:50
本文研究结果表明,通过结合多种治疗性策略,zip-分拣多重CAR多重开关受体T细胞或能克服CAR-T细胞疗法耐受性中的多种分子机制。
对嵌合抗原受体(CAR)T细胞疗法耐药的发生往往通过多种机制,最明显的就是抗原丢失和肿瘤诱导的免疫抑制。近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Leucine zipper-based immunomagnetic purification of CAR T cells displaying multiple receptors”的研究报告中,来自纪念斯隆凯特琳癌症研究中心等机构的科学家们通过研究开发出了一种新方法,其或能为T细胞添加功能从而帮其克服嵌合抗原受体T细胞疗法(CAR-T细胞疗法)耐药的机制。
如今,CAR-T细胞疗法已经彻底改变了癌症的治疗,同时为一些血液癌症患者也提供了强有力的治疗选择,然而没有一种疗法是完美的,一些患者对CAR-T细胞疗法产生了一定的耐药性。Scott E. James教授说道,从历史上来看,在这一领域,人们试图克服肿瘤用来躲避免疫疗法攻击的个体化策略,由于当前的载体系统的DNA包装能力有限,因此对T细胞进行工程化修饰从而对多种策略抵抗一直面临着巨大挑战;这项研究中,我们开发出了一种新方法,其能促进对T细胞中的多种特征进行编码,旨在同时克服多种肿瘤逃逸机制。
目前被批准的CAR-T细胞疗法是从患者血液中提取免疫细胞,随后对其进行重编程来产生CAR,进而识别并结合癌细胞表面所发现的抗原(一种特殊蛋白),然后,这些被工程化改造的T细胞就会被重新输注到患者机体系统中,并在患者体内摧毁靶向性的肿瘤细胞,然而相应的问题也会出现,包括靶向性抗原的低表达会使得T细胞很难看到它。肿瘤基本上对于T细胞而言是不可见的,而一些解决策略就是同时追踪多种不同的抗原或分子,一般而言,大多数方法都涉及靶向作用两种抗原,但研究人员在这一项目中所使用的新型策略能靶向作用高达四种抗原。
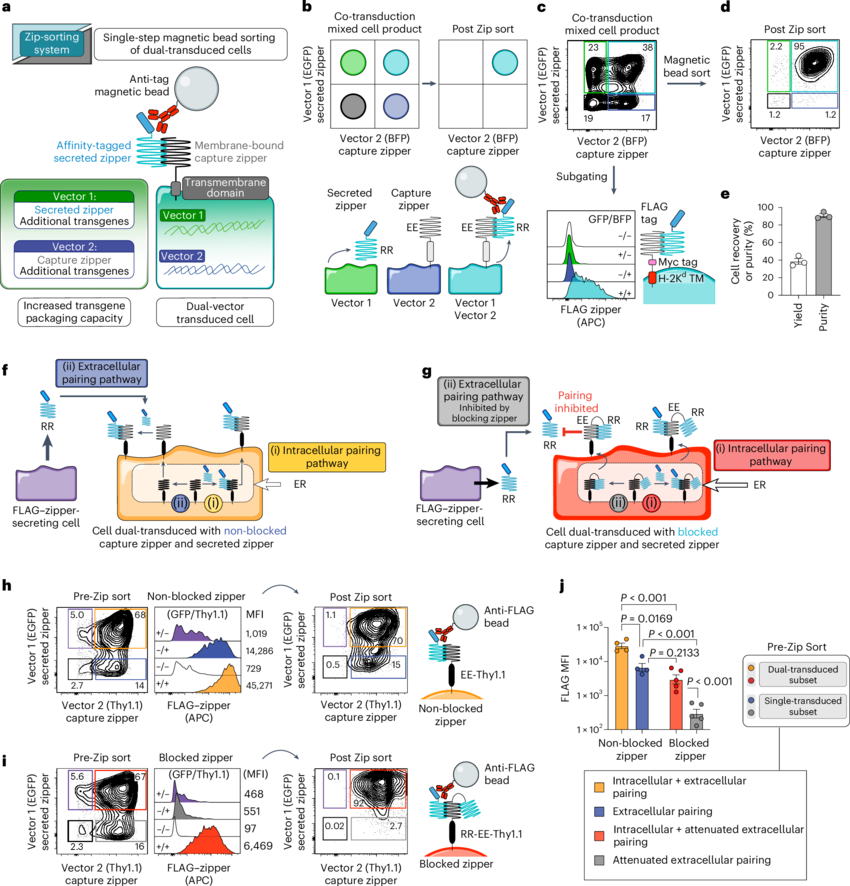
设计出基于亮氨酸拉链的细胞分拣系统
但仅仅在T细胞中增加多个CARs似乎并不容易,研究人员将这一问题比作大脑的储存容量不足,通过利用zip或闪存驱动器,或者在这种情况下使用一种额外的基因运输系统或载体,你的存储容量就会翻一番。基于单一载体方法,我们所能进入细胞的遗传信息是非常有限的,而通过利用两种载体并选择性地纯化能接受这两种载体的细胞,我们就能将用于编码新细胞程序的空间增加一倍。
通过联合研究后,研究人员设计了一种能利用双载体方法来将遗传信息容量加倍的系统,其能同时靶向作用多个抗原;同时这一系统还允许使用开关受体,其能将来自癌细胞的负信号转化为正信号,从而减少T细胞的耗竭,而T细胞耗竭是肿瘤逃逸的另一种机制;这种方法如今已经在高达四种抗原和三种开关受体中进行了相关测试,展现出了更好的抗肿瘤活性,即T细胞增殖地更多且寿命也更长,研究人员将其命名为zip-分拣系统(zip-sorting),其能为构建和比较新型细胞疗法提供一种强大的方法。
研究者James说道,我们建立了这一平台,这样研究人员就能将两倍数量的遗传信息传递到T细胞中,为了证明这一系统的实用性,他们设计出了携带多种受体的T细胞,从而就能对多个靶点分子做出反应并能抵抗肿瘤细胞所介导的免疫抑制效应。到目前为止,这项研究是在小鼠模型中进行的,研究人员希望能优化zip-分拣系统从而在人类细胞中调查这一方法,比如,目前他们正在进行一项计划来测试大量的开关受体,旨在观察哪种组合的效果最佳。
研究者van den Brink表示,我们的原理验证实验表明,T细胞能被工程化改造从而同时克服多种肿瘤耐受机制,这对于临床转化具有非常大的意义;除了使用zip-分拣系统来添加CARs和开关受体外,这一技术还有其它应用,比如潜在的添加转录因子从而使得T细胞增殖地更好,如果T细胞变得过于活跃的话,就能使用安全开关来对其进行剔除。令人惊讶的是,研究人员能将尽可能多的特征放入T细胞中,并且让其在肿瘤微环境中仍然保持活性,而这种活性通常是具有一定抑制性的。
如今研究人员就能设计出躲避多种免疫逃逸策略的细胞,而这在以前是一项重大的挑战,即在同一个细胞中同时设计出对所有这些策略的耐受性,研究人员希望能观察到还能添加什么样的组分来增强CAR-T细胞疗法的长期疗效。综上,本文研究结果表明,通过结合多种治疗性策略,zip-分拣多重CAR多重开关受体T细胞或能克服CAR-T细胞疗法耐受性中的多种分子机制。(生物谷Bioon.com)
参考文献:
James, S.E., Chen, S., Ng, B.D. et al. Leucine zipper-based immunomagnetic purification of CAR T cells displaying multiple receptors. Nat. Biomed. Eng 8, 1592–1614 (2024). doi:10.1038/s41551-024-01287-3
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


